Forschungsprojekte
Am Heimer-Institut werden Untersuchungen zu erblichen und erworbenen Muskelerkrankungen durchgeführt. Die Schwerpunkte liegen dabei auf den Gebieten der klinischen und morphologischen Phänotypisierung, der wissenschaftlichen Grundlagenforschung zur Pathophysiologie der Erkrankungen sowie der Entwicklung von neuen Therapiekonzepten zur Durchführung von klinischen Studien.
Pathophysiologie der Myofibrillären Myopathien
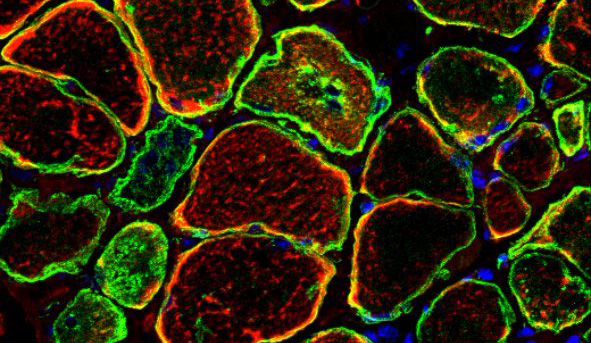
Myofibrilläre Myopathien (MFM) sind erbliche Muskelerkrankungen, die durch eine progressive Schädigung von Skelett- und Herzmuskulatur gekennzeichnet sind, zu progredienten Lähmungen mit meist schweren körperlichen Beeinträchtigungen und oft zum vorzeitigen Tod durch eine Beteiligung der Atemmuskulatur und Beeinträchtigung der Herzfunktionen führen. Morphologische Kennzeichen sind das Auftreten von Desmin-positiven Proteinaggregaten und eine fortschreitende Zerstörung der Myofibrillen. Die Myofibrillären Myopathien sind eine klassische und zahlenmäßig bedeutsame Untergruppe der Proteinaggregationserkrankungen der quergestreiften Muskulatur (PAM). Die bisher identifizierten Gendefekte betreffen Gene, die für Proteine kodieren, die funktionell oder strukturell mit den Myofibrillen assoziiert sind. Bei etwa der Hälfte der Fälle Myofibrillärer Myopathien ist der ursächliche Gendefekt nicht bekannt. Derzeit bestehen keine spezifischen Therapiemöglichkeiten für die von Myofibrillären Myopathien betroffenen Patienten.
In Kooperation mit dem Medizinischen Proteom-Center der Ruhr-Universität Bochum haben wir eine Methode etabliert, mit der wir die Zusammensetzung der Proteinaggregate bei Myofibrillären Myopathien aufzuschlüsseln. Hierzu werden krankhaft veränderte Areale aus menschlichen Muskelgewebeschnitten mittels Laser-Mikrodissektion ausgeschnitten und anschließend massenspektrometrisch analysiert. Diese Proteom-Untersuchungen liefern wertvolle neue Informationen über Proteine und zelluläre Signalwege, die unser Verständnis der Pathogenese der Myofibrillären Myopathien erweitern und auch dabei helfen, verschiedene Formen Myofibrillärer Myopathien zu differenzieren.
Zur Identifikation neuer Gendefekte, die zu Myofibrillären Myopathien führen, lassen wir das gesamte Exom (Whole Exome Sequencing) von Patienten sequenzieren, bei denen histopathologisch eine Proteinaggregationsmyopathie vorliegt und gleichzeitig Mutationen in den bekannten krankheitsrelevanten Genen ausgeschlossen wurden. Um die Komplexität zu reduzieren und aus den so gewonnenen umfangreichen Datensätzen möglichst krankeitsrelevante Aussagen zu erhalten, erfolgt ein Abgleich dieser Daten mit den Proteom-Daten. Hintergrund ist hierbei, dass bei den bisher bekannten Formen Myofibrillärer Myopathien in der Regel auch das betroffene mutierte Protein in den Proteinaggregaten enthalten ist.
Therapiestrategien zur Behandlung Myofibrillärer Myopathien
Im Rahmen mehrerer DFG-geförderter Forschungsprojekte haben wir Zellmodelle hergestellt, die die wesentlichen Aspekte zweier häufiger Formen der Myofibrillären Myopathien, der Desminopathie und der Filaminopathie, sehr gut widerspiegeln. Diese Zellmodelle werden nun dazu eingesetzt, die beiden Erkrankungen mittels eines breiten Spektrums zellbiologischer, molekularbiologischer und biochemischer Methoden sowie mikroskopischer Techniken weiter im Detail zu charakterisieren.
Ein wesentlicher Teil der Arbeiten an den Zellmodellen soll dazu dienen, neue Therapiestrategien zur Behandlung Myofibrillärer Myopathien zu entwickeln. In entsprechenden Projektarbeiten werden gentechnische sowie verschiedene pharmakologische Ansätze verfolgt. Die gentechnischen Ansätze haben zum Ziel, die Expression der normalen, nicht-mutierten Form eines betroffenen Proteins, z.B. des Desmins, wiederherzustellen. Für eine pharmakologische Behandlung werden verschiedene Substanzen hinsichtlich einer protektiven Wirkung auf die fortschreitende Zerstörung der Myofibrillen sowie weiterer krankhaft veränderter Strukturen und Prozesse der Muskelzellen getestet.
Um die Möglichkeiten dieser translationalen Forschungsarbeiten zu stärken und im späteren Verlauf auch Überprüfungen neuer Therapieoptionen an Patienten im Rahmen von klinischen Studien zu ermöglichen, haben wir in Kooperationen mit dem Institut für Neuropathologie der Universität Erlangen-Nürnberg, dem Friedrich-Baur-Institut der Ludwig-Maximilians-Universität München und der Klinik für Kardiologie und Angiologie der Universität Heidelberg ein Register für Patienten mit Proteinaggregationsmyopathien etabliert.
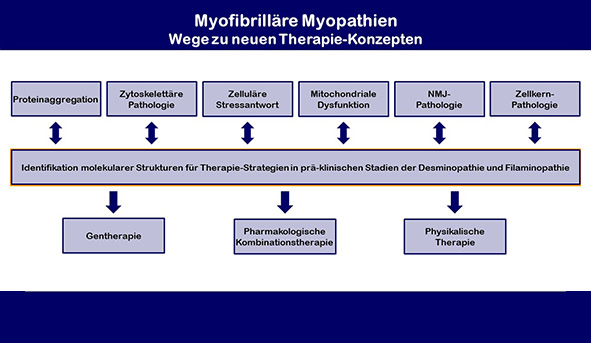
Quantitative MRT-Bildgebung der Muskulatur
In den letzten Jahren hat die quantitative MRT- Bildgebung (qMRT) zunehmend an Bedeutung gewonnen. Dies gilt auch für die Beurteilung verschiedener Muskelerkrankungen. Zusammen mit Dr. Lara Schlaffke haben wir das qMRT als wichtige, nicht-invasive Methode weiter entwickeln können, um den Verlauf von Muskelerkrankungen genauer verfolgen zu können. Der besondere Vorteil liegt darin, dass die qMRT-Untersuchung risikoarm ist, und somit im Verlauf einer Erkrankung häufig wiederholt werden kann.
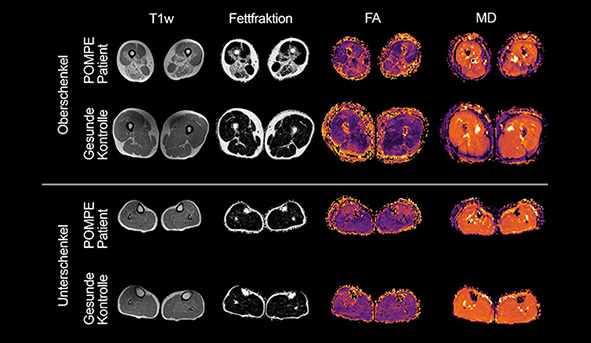
Für die Pompe-Erkrankung (GSD II) konnten wir zeigen, dass bestimmte Gewebsveränderungen (gemessen mit dem Verfahren des sog. „diffusion-tensor-imaging“, DTI) den konventionellen MRT-Auffälligkeiten vorausgehen und somit als „Biomarker“ für ein Fortschreiten der Erkrankung in Betracht kommen. Durch DTI können zudem Strukturveränderungen der Muskulatur nachgewiesen werden, die normalerweise nur unter dem Mikroskop sichtbar sind. Aktuell führen wir klinische Studien durch, um das qMRT routinemäßig in der Diagnostik und Therapie bei Patienten mit Muskelerkrankungen einzusetzen. Des Weiteren arbeiten wir daran, das qMRT zur der Verlaufsbeurteilung von Tiermodellen zu etablieren.
Pathophysiologie der sporadischen Einschlusskörpermyositis
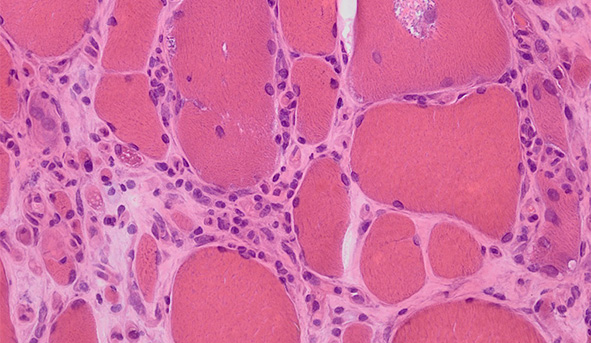
Die sporadische Einschlusskörpermyositis (sIBM) ist die häufigste Muskelerkrankung des höheren Erwachsenenalters und ist durch fortschreitende Lähmungen der Muskulatur gekennzeichnet, insbesondere der Oberschenkel- und Fingerbeugermuskulatur, die im Verlauf der Erkrankung zu schweren Einschränkungen bis hin zur Rollstuhlpflichtigkeit führen können. Zudem kommt es bei vielen Patienten zu Schluckstörungen. In der Muskelbiopsie sind sowohl entzündliche Veränderungen der Muskelfasern als auch „rimmed vacuoles“ nachweisbar, die durch einen Defekt im Abbau von Zellproteinen entstehen.
Analog zu unseren massenspektrometrischen Untersuchungen an Myofibrillären Myopathien führen wir auch an Muskelproben von Patienten mit sporadischer Einschlusskörpermyositis quantitative Proteomanalysen durch. Dazu wurden u.a. die „rimmed vacuoles“ mittels Laser-Mikrodissektion ausgeschnitten, um die dort angereicherten Proteine der zellulären Proteinqualitätskontrolle mittels massenspektrometrischer Analysen nachzuweisen. Dadurch konnten wir bereits neue Erkenntnisse hinsichtlich der Zusammensetzung der „rimmed vacuoles“ bei sIBM gewinnen sowie Hinweise auf krankheitsrelevante zelluläre Signalwege und Adaptationsmechanismen erhalten.
Methodische Schwerpunkte im Heimer Institut (mit integriertem S1-/S2-Labor)
Die Methoden beinhalten die histopathologische Aufarbeitung von Skelettmuskulatur einschließlich Spezialfärbungen, Immunfluoreszenz- und Doppel-Immunfluoreszenz-Analysen, Laser-Mikrodissektion von Muskelgewebe und kultivierten Myoblasten/Myotuben, Muskel-Zellkulturen einschließlich iPSC, Elektrostimulation von Muskelzellen (EPS), Western Blot, RT-PCR, Intellicage.